Nous vous présentions dans cet article : “Purification de protéines : la stratégie CEP” ce qu’est une purification de protéine et la stratégie à suivre pour mener à bien celle-ci.
L’intention de ce nouvel article sur l’ identification, la quantification et la purification des biomolécules est de vous présenter en détails la stratégie CEP (Capture – Enhance – Polishing).
De l’importance d’établir un planning :

Pour rappel, une purification de protéine peut être très complexe, c’est pourquoi il faut la simplifier au maximum en définissant le planning :
1/ Définir l’objectif
- Cible désirée : quelle sera l’utilisation de la protéine, donc quelle doit être sa pureté ?
- Conditions expérimentales : éviter la perte d’activité de la protéine
2 / Décrire
- La protéine à purifier
- Le matériel de départ (milieu dans lequel la protéine est présente)
3/ Développer les conditions analytiques
La Purification Multi-étapes
La stratégie CEP répond à la question : Quelles techniques de purification faut il associer pour mener à bien ma purification multi-étapes ?
Techniques qui doivent être complémentaires et qui doivent réduire le nombre de manipulation.
Pour rappel, les techniques disponibles sont :

Sélection & combinaison de techniques purificatives :
Quel est le chemin pour obtenir la protéine à la pureté nécessaire ?
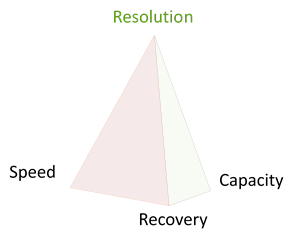
Toutes les techniques offrent un compromis entre Résolution, Capacité & Quantité de produit récupéré. En conséquence, les supports de purification doivent être sélectionnés pour atteindre l’objectif des étapes de la purification (Capture – Enhance – Polishing).
La stratégie CEP comporte 3 étapes :
- Capture : équilibre entre Vitesse & Capacité
- Enhance: équilibre entre Résolution & Quantité
- Polishing: équilibre entre Résolution & Capacité
Capture
Il s’agit de la purification initiale de la molécule d’intérêt à partir du matériel source clarifié. Cette “capture” assure les bases de la véritable purification réalisée lors de l’étape suivante “Enhance”.
C’est un isolement rapide et une concentration de la protéine d’intérêt
Le plus : Concentration et Stabilisation (Elimination des protéases)
Nos conseils pour l’optimisation de cette étape :
Pour augmenter la vitesse et la capacité de charge, utilisez des résines macroporeuses et hautement substituées.
Ainsi, la capture de la protéine d’intérêt est privilégiée quand les contaminants sont rejetés pendant la phase de charge et la pureté de la protéine est optimisée pendant les phases de lavage & d’élution.
Le fait de choisir des résines macroporeuses hautement substituées garantit des vitesses de purification sans pénaliser la capacité de charge dynamique de la colonne.
Les techniques à privilégier sont :
- Echange d’ions & Chromatographie Hydrophobe pour l’industrie
- Affinité, IMAC, Echange d’ions & Chromatographie Hydrophobe pour les laboratoires académiques
Enhance
C’est l’étape pendant laquelle la grande majorité des impuretés est enlevée.
est enlevée.
- La résolution est mise en avant
- L’élution se fait en gradient multi étapes ou continu
- Les techniques séparatives les plus souvent utilisées sont l’échange d’ions et la chromatographie hydrophobe ou l’affinité
- Pour une excellente résolution en HIC ou IEX, chargez la colonne à 20% de sa capacité totale
Nos conseils pour l’optimisation de cette étape :
Lors de cette étape et pour optimiser la sélectivité de la purification, il faut utiliser une technique séparative différente de celle utilisée lors de la 1ére étape de « capture ».
Si, pour une raison ou pour une autre, il n’est pas possible de changer de technique, modifiez la sélectivité : modification du pH si vous travaillez en IEX, de la concentration saline pour le HIC…
Enfin, l’efficacité sera grandement améliorée en utilisant des billes non poreuses de petites tailles.
Polishing
 C’est l’étape finale au cours de laquelle les dernières traces d’impuretés sont éliminées, les molécules très proches (variants de charges, agrégats entre autres) sont séparées.
C’est l’étape finale au cours de laquelle les dernières traces d’impuretés sont éliminées, les molécules très proches (variants de charges, agrégats entre autres) sont séparées.
Les techniques le plus souvent utilisées sont : l’exclusion, l’Echange d’ions & la Chromatographie Hydrophobe.
Si les protéines résistent à des conditions de séparation très agressives, la chromatographie par phase inverse sera utilisée.
Taille des billes– Résolution vs. contre pression
Dans la mesure où chaque étape a un but différent (Dégrossissage, Purification, Polissage) les résines n’auront pas les mêmes caractéristiques. En particulier, la taille des billes sera différente.

D’étape en étape, nous allons vers plus de précision, de résolution. Celle-ci est obtenue, entre autre, par une réduction de la taille des billes. Ainsi, pour l’étape de Capture, des billes de 45 – 100 µm sont suffisantes, alors que pour la dernière étape de polissage des billes de 10 – 20 µm sont à privilégier.
Propriétés de chaque technique de purification

Techniques à associer

Résumé : l’approche systématique du développement d’un projet de purification
- Consacrer du temps à la bonne définition du projet de purification : utilisation de la protéine purifiée, quantité & qualité nécessaire
- Etudier : – à petite échelle quelles résines sont les plus appropriées à la purification
– à échelle intermédiaire quelles techniques et solutions sont compatibles avec la stabilité de l’échantillon - Etape de Capture : concentre l’échantillon et élimine les protéases. Utiliser des colonnes de grande capacité avec des résines macroporeuses
- Etapes suivantes : changer de techniques séparative ou de sélectivité. Utiliser des colonnes plus résolutives (diminution de la taille des billes)
- Réduire au maximum le nombre d’étapes de purification et les manipulations pour garder l’activité protéique la plus élevée possible
- Une SEC est un bon choix dans l’étape de polissage :la molécule d’intérêt est récupérée dans son tampon de stockage
- Avant la purification à grande échelle, optimiser la concentration et les conditions de stockage de la protéine
Dernière recommandation : pour vos purifications gardez en mémoire qu’il vous faut rester le plus simple possible et éviter des processus trop longs : la protéine d’intérêt gardera une activité maximale et vous ferez des économies.